1. Bối cảnh và mục tiêu nghiên cứu
Các thuốc ức chế yếu tố Xa (FXa inhibitors) là các thuốc kháng đông đường uống thế hệ mới (Direct Oral Anticoagulants – DOACs) như rivaroxaban, apixaban và edoxaban. Thuốc có ưu điểm dùng đường uống, liều cố định, khoảng điều trị rộng, không cần giám sát thường xuyên các chỉ số xét nghiệm đông máu, thời gian khởi phát và hết tác dụng nhanh, hiệu quả và an toàn đã được chứng minh ở người lớn. Nhưng dữ liệu an toàn trên trẻ em chưa đầy đủ, đặc biệt về biến cố bất lợi (Adverse Events – AEs) do các thử nghiệm lâm sàng còn giới hạn (ít đối tượng, thời gian theo dõi ngắn, tiêu chí chọn lọc khắt khe). Do đó, nghiên cứu này được thực hiện nhằm tổng hợp hệ thống dữ liệu về AEs từ các thử nghiệm lâm sàng và đối chiếu với dữ liệu thực tế từ Hệ thống báo cáo biến cố bất lợi của Cục Quản lý Thực phẩm và Dược phẩm Hoa Kỳ (FDA Adverse Event Reporting System-FAERS), từ đó giúp bác sĩ đánh giá độ an toàn của thuốc FXa ở trẻ em một cách toàn diện hơn.
2. Phương pháp nghiên cứu
2.1. Thiết kế
Phân tích gộp (meta-analysis): Dựa trên 12 nghiên cứu (6 thử nghiệm lâm sàng đối chứng ngẫu nhiên – RCTs và 6 nghiên cứu một nhánh-Single arm studies), sử dụng mô hình phân cấp Bayes để ước lượng tỷ lệ AEs và độ dị biệt (Heterogeneity- τ). Các nghiên cứu được tìm kiến trên các trang web: PubMed, Embase, Cochrane Library, ClinicalTrials.gov và European Union Clinical Trials Register được công bố bằng tiếng Anh, cho đến ngày 17 tháng 10 năm 2023.
Nghiên cứu cảnh giác dược (pharmacovigilance): Phân tích dữ liệu từ hệ thống báo cáo biến cố bất lợi của FDA (FAERS) từ 1/1/2007 đến 31/12/2023. Phát hiện tín hiệu cảnh báo bằng các tỷ số Odd báo cáo (Reporting Odds Ratio- ROR) và tỷ số báo cáo tương quan (Proportional Reporting Ratio – PRR).
2.2. Đối tượng nghiên cứu
Tổng cộng 1302 bệnh nhi (<18 tuổi) tham gia từ 12 nghiên cứu có sử dụng rivaroxaban, apixaban hoặc edoxaban.
Dữ liệu từ FAERS liên quan đến 279 trẻ em (<18 tuổi) được báo cáo có AEs do FXa inhibitors.
Tiêu chí loại trừ
– Không phải nghiên cứu gốc.
– Không có kết quả báo cáo.
– Nghiên cứu trên đối tượng không phù hợp (ví dụ phụ nữ mang thai).
– Trùng lặp (chỉ giữ lại bản có số liệu AE đầy đủ nhất).
3. Tiêu chí đánh giá
Ước tính tỷ lệ mắc tác dụng bất lợi (AEs) qua tổng hợp dữ liệu từ các thử nghiệm lâm sàng ở trẻ em dùng thuốc FXa.
Xác định và phân tích tín hiệu AEs từ dữ liệu thực tế trong hệ thống báo cáo sự cố bất lợi của FDA (FAERS).
4. Kết quả
Tỷ lệ tác dụng bất lợi
Tỷ lệ AEs chung: 50,6% (95% CrI 33,1–67,2; τ=0,80):
+ Edoxaban có tỷ lệ AEs: 35,5% (95% CrI 10,1–68,0; τ = 0,83),
+ Rivaroxaban có tỷ lệ AEs: 55,0% (95% CrI 27,0–78,9; τ = 0,67),
+ Apixaban có tỷ lệ AEs: 56,8% (95% CrI 22,0–87,6; τ = 0,67),
AEs nghiêm trọng: 9,9% (95%, CrI 3,9–19,5; τ=0,55):
+ Edoxaban có tỷ lệ AEs nghiêm trọng: 7,5% (95% CrI 0,6–28,8; τ = 0,43),
+ Rivaroxaban có tỷ lệ AEs nghiêm trọng: 10,4% (95% CrI 2,6–24,3, τ = 0,71).
+ Apixaban có tỷ lệ AEs nghiêm trọng: 19,3% (95% CrI 3,3–50,7; τ = 0,82).
Tỷ lệ chảy máu nghiêm trọng hoặc có ý nghĩa lâm sàng không nghiêm trọng (clinically relevant nonmajor bleeding – CRNM): 2,4% (95% CrI 0,8–4,8; τ=1,61).
Các tác dụng phụ chảy máu phổ biến: chảy máu cam 8,4% (95% CrI 3,9 –14,9; τ = 1,96), tụ máu dưới da 6,4% (95% CrI 0,5–26,2; τ = 0,54), chảy máu vết thương 3,7% (95% CrI 0,4–13,3; τ = 0,55).
– Tác dụng phụ không do chảy máu phổ biến: sốt 9,2% (95% CrI 4,6–15,3; τ = 1,18); nôn 7,8% (95% CrI 4,0–12,3; τ = 0,08); đau bụng 7,4% (95% CrI 1,5–19,4; τ = 0,84).
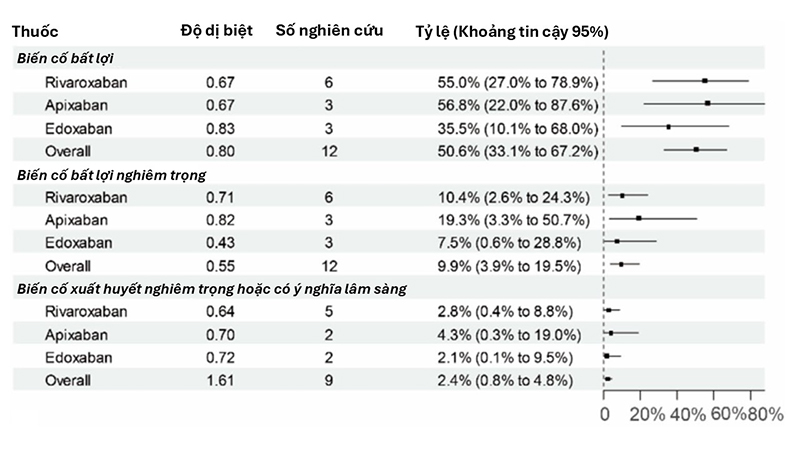
Hình 1: Tỷ lệ các tác dụng bất lợi và các tác dụng bất lợi liên quan đến chảy máu
4.2 Tín hiệu tác dụng bất lợi từ thực tế
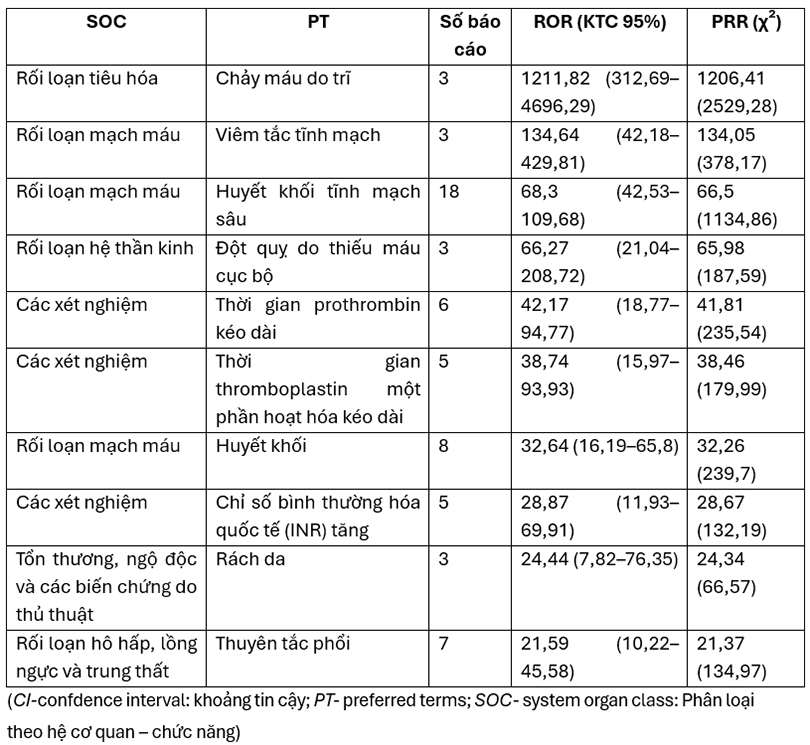
Có 39 tín hiệu AEs được phát hiện trong đó các AEs có ROR cao nhất gồm:
+ Chảy máu trĩ: 1211,82 (95% CI 312,69–4696,29).
+ Viêm tắc tĩnh mạch: 134,64 (95% CI 42,18–429,81).
+ Huyết khối tĩnh mạch sâu: 68,3 (95% CI 42,53–109,68).
Bảng 1: Mức độ tín hiệu cảnh báo các tác dụng bất lợi (AEs) của thuốc ức chế yếu tố Xa ở trẻ em
5. Kết luận:
Thuốc ức chế yếu tố Xa (rivaroxaban, apixaban, edoxaban) có mức độ tác dụng bất lợi chấp nhận được ở trẻ em, đặc biệt khi dùng sau điều trị bằng thuốc chống đông truyền thống như heparin. Các nghiên cứu ghi nhận tỷ lệ tác dụng bất lợi chung là 50,6%, tác dụng bất lợi nghiêm trọng là 9,9% và tương đối đồng nhất với τ=0,80 và τ=0,55. Các tỉ lệ này và không cao hơn so với các thuốc chống đông kinh điển như UFH hoặc LMWH. Tỷ lệ chảy máu nghiêm trọng hoặc có ý nghĩa lâm sàng không nghiêm trọng là 2,4% (τ=1,61) và các tác dụng phụ phổ biến nhất là chảy máu cam 8,4% (τ = 1,96) nhưng không đồng nhất với độ dị biệt giữa các nghiên cứu τ >1,5. Điều này có thể giải thích do sự khác biệt về đặc điểm bệnh nhân, liều lượng thuốc, thời gian điều trị hoặc các yếu tố khác không được kiểm soát trong mỗi nghiên cứu. Qua nghiên cứu cảnh giác dược gợi ý nên kiểm tra trực tràng trước khi dùng thuốc ức chế yếu tố Xa cho trẻ em do khả năng xuất huyết trĩ cao (ROR=1211,82). Ngoài ra, tín hiệu báo cảnh giác dược về viêm tắc tĩnh mạch (ROR=134,64) và huyết khối tĩnh mạch sâu: (ROR=68,3) cũng cần được quan tâm mặc dù các tác dụng bất lợi này không phải do thuốc mà có thể là do tình trạng bệnh hoặc tuân thủ thuốc của bệnh nhân.
Biên tập: ThS.DS. Nguyễn Văn Dũng, DS. Nguyễn Việt Anh
Nguồn: Shan Chong, et al. Paediatric Drug, 5-2025;27(3):351-366. DOI: 10.1007/s40272-024-00665-3