Trẻ em với hệ thần kinh trung ương (CNS) đang phát triển và đặc biệt dễ bị tổn thương bởi các tác động gây độc tế bào của hóa trị. Điều này liên quan đến quá trình tạo tế bào thần kinh, myelin hóa và phát triển khớp thần kinh vẫn đang diễn ra liên tục.8 Hóa trị sử dụng các loại thuốc nhắm mục tiêu vào các tế bào phân chia nhanh chóng trên khắp cơ thể để tiêu diệt tế bào ung thư, nhưng đồng thời cũng có thể gây tổn thương các tế bào khỏe mạnh bao gồm cả các tế bào não và tủy sống.3 Độc tính thần kinh trung ương có thể ảnh hưởng đến nhiều chức năng não bộ, bao gồm nhận thức (trí nhớ, sự chú ý, chức năng điều hành), kỹ năng vận động, nhận thức cảm giác và hành vi, tác động đáng kể đến sự phát triển và hoạt động hàng ngày của trẻ.1 Việc nhận biết sớm và quản lý chủ động là vô cùng quan trọng để giảm thiểu mức độ nghiêm trọng và khả năng không hồi phục của tổn thương thần kinh, từ đó tối ưu hóa kết quả điều trị lâu dài và chất lượng cuộc sống của bệnh nhân.5
1. Cơ chế và biểu hiện độc tính CNS của một số thuốc hóa trị
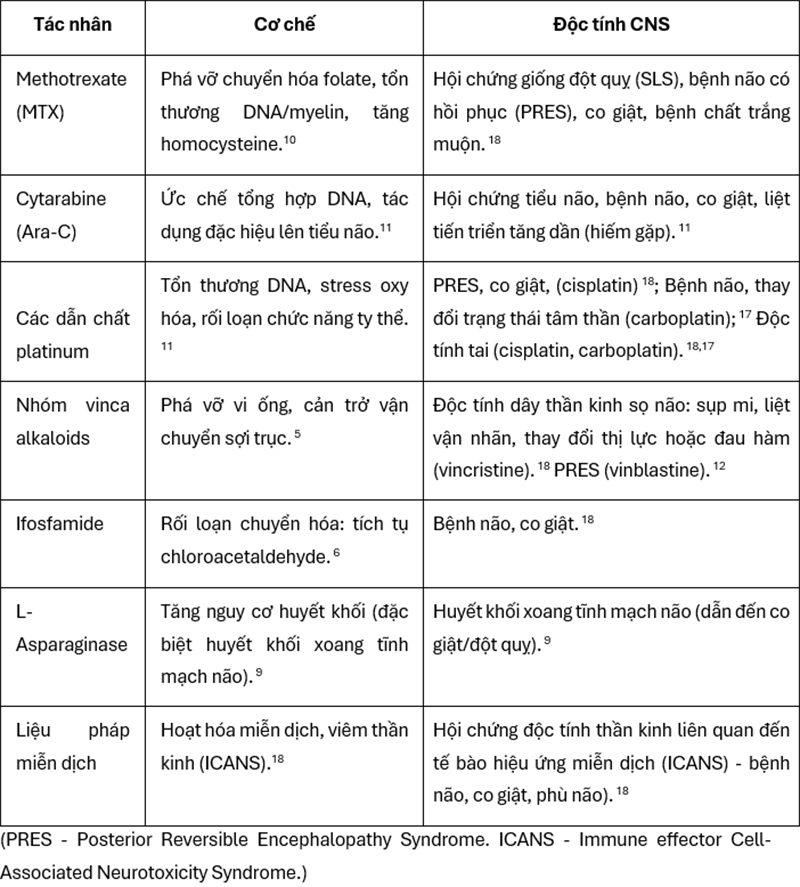
Cơ chế chính xác của độc tính thần kinh do hóa trị liệu chưa được hiểu đầy đủ và khác nhau tùy thuộc vào loại thuốc. Tuy nhiên, có thể tóm tắt cơ chế và biểu hiện độc tính của một số hóa chất thường dùng trong điều trị ung thư ở trẻ em như sau:
Bảng 1: Cơ chế độc tính CNS tiềm ẩn theo tác nhân hóa trị liệu chính
Một số yếu tố khác cần lưu ý có thể làm tăng nguy cơ độc tính thần kinh bao gồm:
Yếu tố thuộc về phác đồ điều trị: Dùng liều điều trị cao, tích lũy liều, thời gian điều trị kéo dài, phương pháp dùng thuốc (tiêm tủy sống có nguy cơ cao hơn so với tiêm truyền tĩnh mạch), liệu pháp kết hợp với nhiều tác nhân độc thần kinh, sử dụng đồng thời một số loại thuốc khác (ví dụ: thuốc ức chế CYP3A4 với vincristine, thuốc cản trở thanh thải MTX/Ara-C qua thận) hoặc tiền sử xạ trị.14 Việc sử dụng phổ biến các phác đồ phối hợp nhiều thuốc hóa trị làm tăng thêm sự phức tạp trong quản lý các độc tính trên thần kinh, vì các thuốc có thể có tác dụng cộng gộp hoặc hiệp đồng trên độc tính.15 Điều này đòi hỏi cần chẩn đoán, theo dõi và ghi chép hồ sơ bệnh án cẩn thận trên lâm sàng.
Liên quan đến bệnh nhân: Độ tuổi (trẻ nhỏ đặc biệt <3 tuổi có nguy cơ CNS cao hơn), yếu tố gen di truyền (bệnh nhân mang gen: CYP3A5, ABCC2, ABCC1, ABCB1, CEP72 độc tính CNS cao hơn khi dùng vincristine; gen ATXN1 SNP gây độc tính CNS cao hơn trong bệnh bạch cầu cấp – ALL), rối loạn chức năng thận hoặc gan, tiền sử tăng men gan (tăng độc tính thần kinh do MTX)14
2. Phòng ngừa độc tính CNS
Mặc dù đã có nhiều nghiên cứu, nhưng hiện tại còn thiếu bằng chứng rõ ràng để đưa ra khuyến cáo với từng các tác nhân dược lý cụ thể trong phòng ngừa độc tính thần kinh do hóa trị liệu, đặc biệt là độc tính CNS.15 Có thể cân nhắc tham khảo một số khuyến cáo như sau:
MTX liều cao: tập trung vào đảm bảo thải trừ nhanh chóng và giảm thiểu độc tính thận vốn là yếu tố làm tăng độc tính trên thần kinh. Các biện pháp bao gồm: bù nước tích cực, kiềm hóa nước tiểu (duy trì pH nước tiểu ≥ 7,0) và điều trị giải cứu bằng leucovorin. Giám sát nồng độ MTX trong huyết thanh là rất quan trọng để đưa ra giải pháp cho điều trị giải cứu. Cần lưu ý tránh dùng đồng thời các loại thuốc làm giảm thanh thải MTX.18 Dextromethorphan (kháng thụ thể NMDA), Aminophylline (đối kháng adenosine) là những thuốc đã được dùng để điều trị độc tính thần kinh do MTX.4
Cytarabine liều cao: Phòng ngừa độc tính tiểu não bao gồm đánh giá thần kinh thường xuyên, giảm liều dựa trên chức năng thận và có thể sử dụng phác đồ một lần mỗi ngày thay vì hai lần mỗi ngày. Sử dụng thuốc nhỏ mắt corticosteroid để dự phòng với độc tính mắt.7
Ifosfamide: Phòng ngừa bệnh não gồm thường xuyên đánh giá độc tính thần kinh, kéo dài thời gian truyền và có thể sử dụng xanh methylene đường tĩnh mạch dự phòng, đặc biệt ở bệnh nhân có nguy cơ cao hoặc có tiền sử phản ứng.6 Thiamine cũng có thể có vai trò hỗ trợ giảm độc tính thần kinh.6
Các tác nhân Platinum: Phòng ngừa độc tính tai (một dạng độc tính dây thần kinh sọ não) thường được quan tâm. Sử dụng sodium thiosulfate (STS) để bảo vệ tai hiệu quả đối với nguy cơ mất thính lực do cisplatin.13 Bù nước và theo dõi điện giải đặc biệt là magie có vai trò quan trọng trong phòng ngừa độc tính thận từ đó có thể góp phần vào giảm độc tính chung.18
Vincristine: Xét nghiệm dược lý gen đối với các biến thể trong các gen như CYP3A5 và các chất vận chuyển ABC (ABCB1, ABCC1, ABCC2) hiện đang được quan tâm nghiên cứu như một giải pháp sàng lọc bệnh nhân có nguy cơ cao độc tính thần kinh và có thể giúp xác định liều tối ưu vincristin.14
L-Asparaginase: để giảm thiểu độc tính chuyển sang sử dụng các dạng PEG hóa (pegaspargase, calaspargase pegol) ít gây phản ứng miễn dịch hơn asparaginase E. coli tự nhiên. Cân nhắc chuyển sang asparaginase Erwinia trong trường hợp quá mẫn.9 L-carnitine đang được nghiên cứu để phòng ngừa độc tính của thuốc.16
3. Các phương pháp điều trị độc tính thần kinh trung ương (CNS)
Quản lý độc tính CNS do hóa trị liệu bao gồm nhận biết kịp thời, chăm sóc hỗ trợ và điều trị đặc hiệu theo triệu chứng.15 Điều này thường đòi hỏi tiếp cận đa ngành bao gồm các bác sĩ ung bướu, bác sĩ thần kinh, dược sĩ và chuyên gia phục hồi chức năng. Một số hướng dẫn điều trị triệu chứng độc tính CNS như sau:
Co giật: Điều trị bằng thuốc chống động kinh (AEDs). Các phác đồ điều trị hỗ trợ thường bao gồm ổn định ban đầu, xác định nguyên nhân (bao gồm rối loạn chuyển hóa) và sử dụng AEDs thích hợp trong đó levetiracetam và phenytoin được đề cập là các lựa chọn.18
Bệnh não có thể hồi phục (PRES): Cần kiểm soát huyết áp, sử dụng AEDs để kiểm soát co giật và ngừng sử dụng tác nhân gây bệnh.18
Bệnh não: Chăm sóc hỗ trợ là giải pháp chính bên cạnh việc ngừng sử dụng tác nhân gây bệnh. Điều trị đặc hiệu có thể bao gồm xanh methylene cho bệnh não do ifosfamide.11 Corticosteroid và các liệu pháp kháng cytokine có thể được sử dụng cho ICANS nặng.4
Độc tính dây thần kinh sọ não: Quản lý phụ thuộc vào các triệu chứng cụ thể. Đối với độc tính tai do platinum, cần theo dõi thính lực và các can thiệp hỗ trợ.2
Quản lý các biến cố độc tính CNS cấp tính là một thách thức phức tạp đòi hỏi chuyên môn đa ngành để chẩn đoán chính xác, điều trị đặc hiệu theo triệu chứng kết hợp giải pháp hỗ trợ tối ưu.
4. Kết luận
Độc tính thần kinh trung ương do hóa trị liệu là thách thức lớn và thường gặp trong điều trị ung thư trẻ em. Tỷ lệ mắc độc tính thần kinh ở trẻ em được báo cáo rất khác nhau, cùng với khó khăn trong việc nhận biết và đánh giá ở trẻ nhỏ dẫn đến đánh giá thấp các tác động của độc tính thần kinh trung ương trong quá trình điều trị cũng như cuộc sống trẻ sau này. Để cải thiện kết quả cho trẻ em điều trị ung thư, cần có những nỗ lực để:
Phát triển các công cụ đánh giá độc tính thần kinh ở trẻ em được chuẩn hóa và nhạy cảm hơn để nhận biết sớm và chính xác.
Nghiên cứu sâu hơn về cơ chế bệnh sinh đặc trưng theo thuốc để xác định các mục tiêu tiềm năng cho các tác nhân bảo vệ thần kinh.
Tiến hành các thử nghiệm lâm sàng lớn, ngẫu nhiên, có đối chứng để đánh giá hiệu quả của các chiến lược phòng ngừa và điều trị tiềm năng.
Xây dựng và triển khai các hướng dẫn thực hành lâm sàng dựa trên bằng chứng cụ thể cho độc tính CNS do hóa trị liệu ở trẻ em.
Tăng cường các mô hình chăm sóc đa ngành và các chương trình theo dõi dài hạn để quản lý hiệu quả các biến cố cấp tính và giải quyết các di chứng lâu dài, đảm bảo chất lượng cuộc sống tốt nhất cho những người sống sót.
TÀI LIỆU THAM KHẢO
1. American Cancer Society. (2023). Late and long-term effects of childhood cancer treatment. https://www.cancer.org/cancer/childhood-cancer/late-effects-of-childhood-cancer-treatment.html
2. Antonio; et al. (2013). Platinum compounds in children with cancer: Toxicity and clinical management. ResearchGate record. http://dx.doi.org/10.1097/CAD.0b013e3283650bda
3. Canadian Cancer Society. (2024). Chemotherapy for childhood brain and spinal cord tumours. https://cancer.ca/en/cancer-information/cancer-types/brain-and-spinal-cord-childhood/treatment/chemotherapy
4. Cheung, Y. T., & Krull, K. R. (2022). Managing therapy-associated neurotoxicity in children with acute lymphoblastic leukemia. Frontiers in Oncology, 12, Article 842634. https://pmc.ncbi.nlm.nih.gov/articles/PMC8791096/
5. Mora, E., et al (2016). Vincristine-induced peripheral neuropathy in pediatric cancer patients. Current Opinion in Supportive and Palliative Care, 10(2), 155–167. https://pmc.ncbi.nlm.nih.gov/articles/PMC5126263/
6. EviQ. (2022). Ifosfamide-induced encephalopathy (Clinical resource No. 177). https://www.eviq.org.au/clinical-resources/side-effect-and-toxicity-management/prophylaxis-and-treatment/177-ifosfamide-induced-encephalopathy
7. EviQ. (2022). Neurotoxicity associated with high dose cytarabine (Clinical resource No. 1742). https://www.eviq.org.au/clinical-resources/side-effect-and-toxicity-management/neurological-and-sensory/1742-neurotoxicity-associated-with-high-dose-cytar
8. Hardy, K. K., et al (2017). Standard of care for neuropsychological monitoring in pediatric neuro-oncology: Lessons from the Children’s Oncology Group (COG). Pediatric Blood & Cancer, 64(8), e26424. https://pmc.ncbi.nlm.nih.gov/articles/PMC5222571/
9. Hijiya, N., & van der Sluis, I. M. (2021, March). Asparaginase therapy in pediatric acute lymphoblastic leukemia: A focus on acute pancreatitis. The Oncology Pharmacist, 14(2). https://theoncologypharmacist.com/issues/2021/march-2021-vol-14-no-2/asparaginase-therapy-in-pediatric-acute-lymphoblastic-leukemia
10. Howard, S. C., et al (2016). Preventing and managing toxicities of high-dose methotrexate. The Oncologist, 21(12), 1471–1482. https://doi.org/10.1634/theoncologist.2015-0164
11. Halina Was , Agata Borkowska , Ana Bagues (2022). Mechanisms of chemotherapy-induced neurotoxicity. Frontiers in Pharmacology. doi: 10.3389/fphar.2022.750507
12. Magalhães, S., Lopes, A., Lima, R., Pereira, S., & Ribeiro, J. (2023). Vinblastine-induced posterior reversible encephalopathy syndrome in pediatric Hodgkin lymphoma. Indian Journal of Medical and Paediatric Oncology, 44(3), 323–325. https://doi.org/10.1055/s-0044-1790585
13. Oeffinger, K. C., et al (2022). Long-term follow-up care for childhood, adolescent, and young adult cancer survivors. JCO Oncology Practice, 18(5), 301–309. https://pmc.ncbi.nlm.nih.gov/articles/PMC9014377/
14. Kandula, T., et al (2016). Pediatric chemotherapy-induced peripheral neuropathy: A systematic review of current knowledge. Cancer Treatment Reviews, 50, 118–128. https://doi.org/10.1016/j.ctrv.2016.09.005
15. Patel, S. K., & Kim, S. (2022). Short and long-term toxicity in pediatric cancer treatment: Central nervous system damage. Cancers, 14(6), 1540. https://doi.org/10.3390/cancers14061540
16. Vrooman, L. M. (2024, February 14). Pediatric-inspired asparaginase regimens for patients with acute lymphocytic leukemia. Cancer Network, 38(2), 82–85. https://www.cancernetwork.com/view/pediatric-inspired-asparaginase-regimens-for-patients-with-acute-lymphocytic-leukemia
17. BC Cancer Agency. (2023). Drug name: Carboplatin (Drug monograph). http://www.bccancer.bc.ca/drug-database site/Drug%20Index/Carboplatin_monograph.pdf
18. Dietrich, J., et al. (2020). Management of CNS toxicity of chemotherapy and targeted agents: 2020. European Journal of Cancer. https://pmc.ncbi.nlm.nih.gov/articles/PMC7471356/
Biên tập: ThS.DS. Nguyễn Văn Dũng, DS. Nguyễn Việt Anh