Trên thế giới, đã có hơn 100 loại kháng thể đơn dòng được cấp phép sử dụng hoặc đang trong quá trình nghiên cứu. Cơ chế tác dụng của các kháng thể này vô cùng đa dạng, phụ thuộc vào đích kháng nguyên và mục tiêu điều trị. Bài viết này tổng hợp và tóm tắt một số cơ chế của kháng thể đơn dòng liên quan đến điều trị ung thư, bệnh tự miễn, bệnh máu ác tính trên trẻ em.
1. Nguồn gốc, bản chất
Kháng thể có bản chất là các chuỗi protein, bao gồm một chuỗi nặng và một chuỗi nhẹ nối với nhau bằng cầu nối disulfat tạo thành cấu trúc hình chữ Y. Về cấu trúc, vùng kết hợp với kháng nguyên (CDR) nằm trong đoạn liên kết kháng nguyên (Fab) của mAbs là vị trí kháng thể (paratope) gắn với epitope của kháng nguyên. Vị trí gắn này đặc trưng cho từng mAbs, tạo nên tính đặc hiệu đích cao và hạn chế tác dụng không mong muốn. Đoạn cố định (Fc) của mAbs thể hiện tác dụng thông qua khả năng liên kết với thụ thể gamma Fc (FcγR) trên bề mặt các tế bào 1,2.
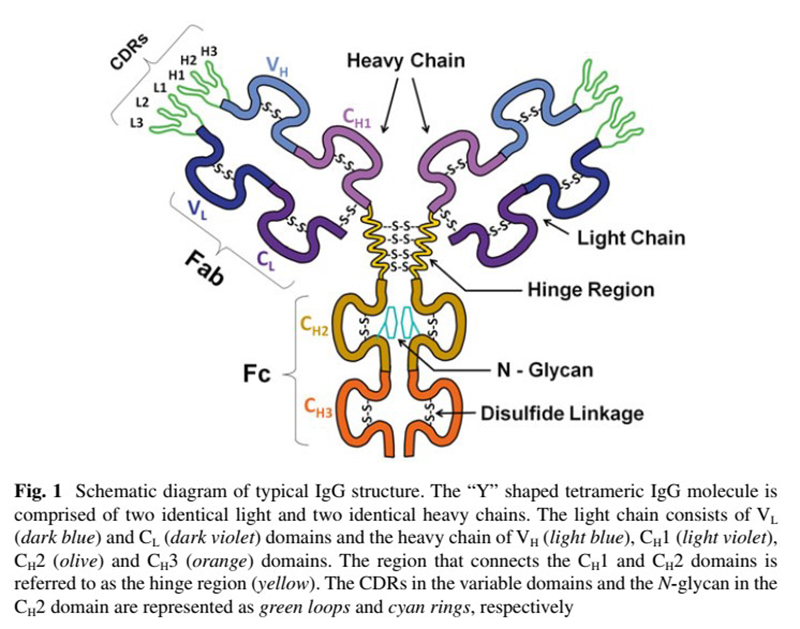
Hình 1. Cấu trúc kháng thể 2
Tùy vào trình tự chuỗi nặng, kháng thể được phân thành 5 lớp: IgM, IgD, IgG, IgE và IgA, trong đó mỗi lớp được phân thành các type nhỏ hơn như IgG1, IgG2, IgG3 và IgG4. Tất cả các kháng thể đơn dòng (mAbs) được sử dụng trên lâm sàng hiện nay đều có bản chất là IgG do lớp này có thời gian bán thải kéo dài và khả năng sản xuất tương đối dễ dàng 2,3.
Trong lớp kháng thể IgG, IgG1 và IgG3 có khả năng gắn vào các tế bào tiêu diệt tự nhiên, các tế bào miễn dịch, kích hoạt cơ chế độc tế bào phụ thuộc kháng thể và độc tế bào phụ thuộc bổ thể, vì vậy được sử dụng rộng rãi trong điều trị ung thư. Ngược lại, IgG2 và IgG4 tác động kém, thậm chí có thể giảm mức độ tác động diệt tế bào thông qua kỹ thuật sản xuất, do đó thường được sử dụng cho mục đích điều trị bệnh liên quan đến miễn dịch mà không muốn gây ra tác động diệt tế bào 3,4.
2. Cơ chế tác dụng
2.1. Cơ chế tiêu diệt tế bào
Đích của các kháng thể đơn dòng thường là các kháng nguyên đặc hiệu hoặc biểu hiện quá mức trên tế bào, từ đó tiêu diệt tế bào ung thư theo nhiều cơ chế. Các cơ chế tiêu diệt tế bào được tổng hợp trong Hình 2 4.
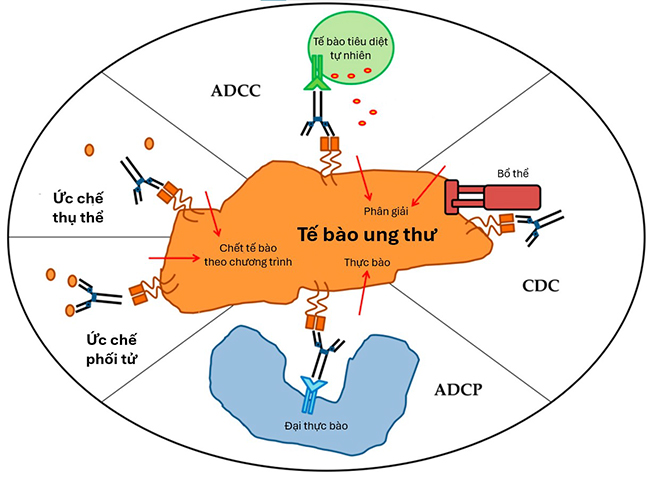
Hình 2. Cơ chế tiêu diệt tế bào ung thư 4. ADCC: Độc tế bào phụ thuộc kháng thể; CDC: Độc tế bào phụ thuộc bổ thể; ADCP: Thực bào phụ thuộc kháng thể.
Trung hòa thụ thể/gián đoạn tín hiệu
Kháng thể có thể gắn vào kháng nguyên, phối tử (ligand) hoặc thụ thể (receptor) có trên bề mặt tế bào đích, từ đó ức chế con đường truyền tín hiệu, ức chế sự lớn lên và tăng sinh của tế bào cũng như kích thích cơ chế tiền apoptosis (chết tế bào theo chương trình) 1. Ví dụ, rituximab là kháng thể được sử dụng để điều trị tình trạng tăng sinh bất thường tế bào lympho, gắn vào vào đích CD20 trên tế bào ung thư bằng tương tác giữa FcγR trên thành tế bào và vùng Fc trên kháng thể đơn dòng. Tế bào ung thư sau đó kích hoạt sự chết theo chương trình và một số cơ chế tiêu diệt khác 3.
Độc tế bào phụ thuộc kháng thể (ADCC)
ADCC là cơ chế mà các kháng thể định hướng tế bào miễn dịch như tế bào tiêu diệt tự nhiên (natural kill – NK), đại thực bào, bạch cầu đa nhân tới tấn công và tiêu diệt tế bào ung thư mang kháng nguyên 1,4. Phần Fc trên kháng thể đơn dòng gắn với thụ thể Fc và hoạt hóa tế bào NK. Tế bào NK sau khi được hoạt hóa trực tiếp giải phóng chất độc tế bào như perforin và granzyme để tiêu diệt tế bào ung thư. Ngoài ra, tế bào NK cũng giải phóng các cytokin tiền viêm, thu hút tế bào miễn dịch khác 1.
Độc tế bào phụ thuộc bổ thể (CDC)
Kháng thể đơn dòng có thể hoạt hóa bổ thể theo con đường cổ điển, khi thành phần C1 liên kết với vùng Fc của kháng thể, dẫn tới hình thành C3a và C3b. C3a sau đó thu hút các tế bào miễn dịch tới vị trí hoạt hóa, trong khi C3b tiếp tục con đường cổ điển và cuối cùng hình thành phức hợp tấn công màng (membrance attack complex – MAC), gây phân giải tế bào 1.
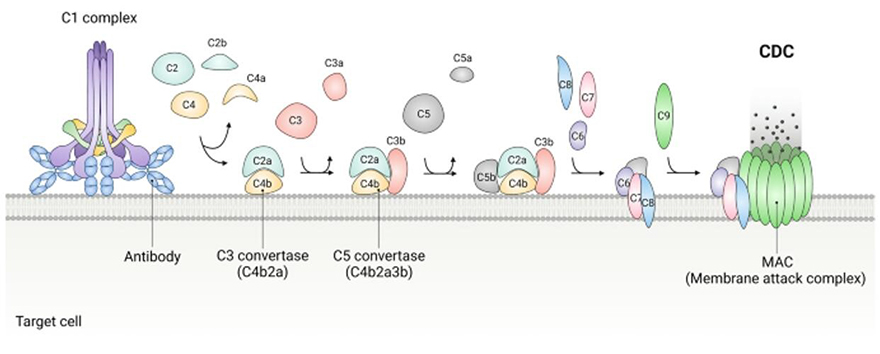
Hình 3. Cơ chế độc tế bào phụ thuộc bổ thể 5
Thực bào phụ thuộc kháng thể (ADCP)
Kháng thể đơn dòng IgG1 hoặc IgG3 có thể đánh dấu tế bào ung thư bằng cách tạo thành phức hợp kháng nguyên – kháng thể với các kháng nguyên đặc trưng trên bề mặt. ADCP xảy ra khi FcγRI trên bề mặt đại thực bào gắn với tế bào ung thư đã được đánh dấu. Hiện tại chưa có nhiều nghiên cứu về tác động của ADCP, tuy nhiên một số bằng chứng cho thấy cơ chế này đóng vai trò quan trọng trong tiêu diệt tế bào khối u lưu thông (circulating tumour cells – CTC) gây ra sự xuất hiện của tình trạng di căn 4.
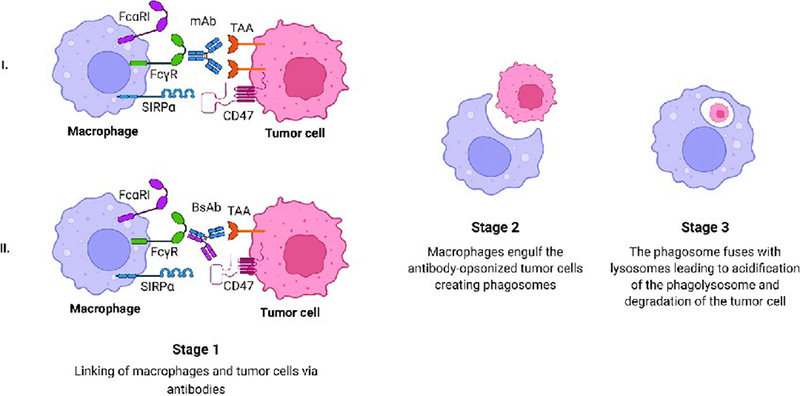
Hình 4. Cơ chế thực bào phụ thuộc kháng thể 6
2.2. Cơ chế điều hòa đáp ứng miễn dịch
Ức chế điểm kiểm soát miễn dịch
Khả năng điều hòa đáp ứng miễn dịch của các kháng thể đơn dòng đã trở thành một trong những xu hướng tiếp cận điều trị mới cho các bệnh nhân ung thư. Các nghiên cứu đang được thực hiện trên một số kháng thể đơn dòng cho thấy khả năng chặn tác dụng của thụ thể ức chế tế bào miễn dịch (VD: tế bào T), giúp tăng cường một phần chức năng tế bào 1.
Bên cạnh đó, quá trình hoạt hóa thụ thể đồng kích thích (costimulatory receptors) cũng ảnh hưởng tới đáp ứng miễn dịch trong ung thư. Để hoạt hóa tế bào T, tín hiệu ban đầu được hình thành do sự gắn của thụ thể trên màng tế bào với kháng nguyên qua phức hợp MHC I hoặc II. Sau đó, tín hiệu thứ hai được hình thành khi thụ thể đồng kích thích (costimulatory molecules) trên tế bào T gắn với các yếu tố kích thích. Tín hiệu kép hoạt hóa tế bào T và kích thích tăng sinh tế bào. Một số kháng thể đơn dòng hoạt động theo cơ chế kích thích tín hiệu thứ hai đang được nghiên cứu và phát triển 1.
Ức chế yếu tố hoại tử khối u (TNF-α)
TNF-α là cytokin có trong đại thực bào, tế bào lympho và một số tế bào khác sau khi được hoạt hóa. Về mặt sinh lý, sự có mặt của TNF-α đóng vai trò quan trọng trong phản ứng viêm chống lại các tác nhân gây bệnh. Tuy nhiên, việc sản xuất TNF-α quá mức lại liên quan tới cơ chế bệnh sinh của một số bệnh tự miễn. Hiện tại, kháng thể đơn dòng ức chế hoạt động của TNF-α đã được cấp phép sử dụng để kiểm soát nhiều bệnh tự miễn như viêm khớp dạng thấp, bệnh Crohn, bệnh viêm loét đại tràng…1,7
Ức chế interleukin (IL)
Interleukin là nhóm các cytokin có vai trò quan trọng trong sự phân hóa và kích hoạt tế bào miễn dịch. Các kháng thể đơn dòng ức chế đích IL-1, IL-2, IL-6, IL-17, IL-17A, IL-12 và IL-23 đã được sử dụng để điều trị bệnh tự miễn 1.
Ức chế tế bào B, loại bỏ tế bào B và tế bào T
Tế bào lympho B không chỉ sinh kháng thể mà còn hoạt động như một tế bào trình diện kháng nguyên, hoạt hóa tế bào T sinh các cytokin. Việc loại bỏ tế bào lympho B và T có liên quan tới cải thiện lâm sàng trên các bệnh nhân mắc bệnh tự miễn 1,3.
3. Cơ chế một số thuốc cụ thể
Rituximab
Rituximab là kháng thể đơn dòng, gắn đặc hiệu vào kháng nguyên xuyên màng CD20 trên bề mặt tế bào tiền lympho B (pre-B) và lympho B trưởng thành. Kháng nguyên CD20 biểu hiện ở trên 95% của tất cả các tế bào B u lympho không Hodgkin nhưng lại không có trong các tế bào gốc tạo máu, giai đoạn tiền lympho B bình thường và các mô bình thường khác 8.
Khi rituximab gắn với kháng nguyên CD20 trên các tế bào u lympho B sẽ kích hoạt các phản ứng miễn dịch gián tiếp để tiêu tế bào B. Cơ chế tiêu diệt tế bào chưa hoàn toàn rõ, có thể bao gồm độc tính tế bào phụ thuộc bổ thể (CDC), độc tính tế bào phụ thuộc kháng thể (ADCC) và gây cảm ứng chết tế bào theo chương trình (apoptosis) 9.
Hiện tại, rituximab được chỉ định trong một số bệnh như u lympho non-Hodgkin dòng B với CD20 dương tính, bạch cầu mạn dòng lympho CD20 dương tính.
Adalimumab và infliximab
Về cấu trúc, đoạn Fc và một phần đoạn Fab trên cả hai kháng thể đơn dòng đều được cấu tạo từ chuỗi IgG1 của người. Điểm khác biệt nằm ở CDR có vai trò gắn đặc hiệu với kháng nguyên. Ở infliximab, CDR có nguồn gốc từ chuột, trong khi ở adalimumab, nguồn gốc của vùng CDR đến từ người 10.
Cơ chế hoạt động của adalimumab và infliximab liên quan đến khả năng gắn kết ái lực cao với TNF-α tiết ra từ các tế bào miễn dịch. Nhờ cơ chế này, adalimumab và infliximab ức chế tình trạng viêm và các biểu hiện rối loạn do viêm liên quan đến vai trò của TNF-α. Ví dụ, trong viêm khớp, TNF tạo điều kiện cho việc kích hoạt các phối tử NF-κB trên tế bào mô đệm hoặc tế bào tạo xương, tăng sự phá hủy sụn và xương, đồng thời kích thích sự trưởng thành và hoạt hóa của tế bào hủy xương. Các tác nhân chống TNF vì vậy có vai trò quan trọng và toàn diện trong điều trị viêm khớp 11,12.

Tới nay, adalimumab đã được cấp phép trên trẻ em trong điều trị viêm khớp dạng thấp và viêm khớp tự phát tuổi thanh thiếu niên (kết hợp với methotrexat), bệnh viêm ruột mạn tính (bệnh Crohn), vảy nến thể mảng và viêm màng bồ đào. Đối với infliximab, các chỉ định bao gồm điều trị bệnh Crohn, bệnh viêm loét đại tràng ở trẻ em.
Tocilizumab
Tocilizumab là kháng thể đơn dòng liên kết chọn lọc với IL-6, từ đó ngăn IL-6 liên kết với thụ thể của nó trên gan, phổi và nguyên bào sợi hoạt dịch. Việc ức chế phức hợp thụ thể làm ngăn chặn sự truyền tín hiệu đến các chất trung gian hóa học thu hút tế bào B và T, từ đó giảm tình trạng viêm mạn tính liên quan đến IL-6 13.
Tocilizumab được khuyến cáo sử dụng đơn trị hoặc phối hợp với các thuốc khác trên bệnh nhi viêm khớp thiếu niên tự phát thể đa khớp và thể hệ thống.
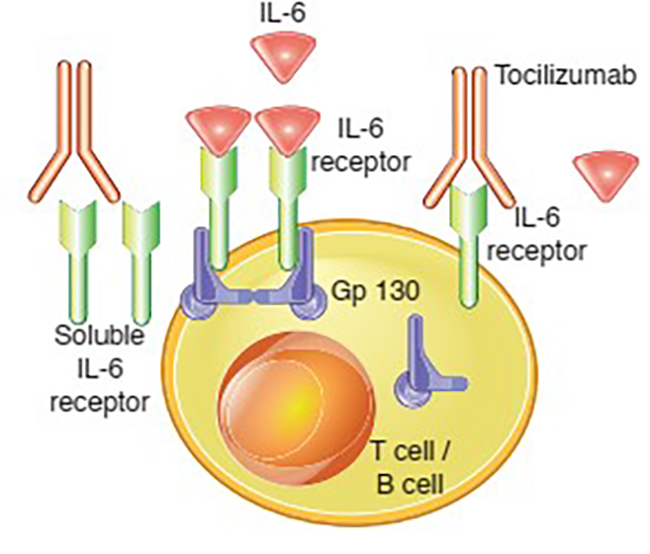
Hình 6. Cơ chế tác dụng của tocilizumab 1
Basiliximab
Basiliximab là kháng thể đơn dòng có nguồn gốc người/chuột có tác dụng ức chế chuỗi α của thụ thể IL-2 (kháng nguyên CD25) biểu hiện trên bề mặt tế bào lympho T. Theo các nghiên cứu, IL-2 và thụ thể của nó đóng vai trò trung tâm trong hoạt hóa tế bào lympho T và phản ứng miễn dịch sau cấy ghép 14.
Trên lâm sàng, basiliximab được sử dụng với chỉ định dự phòng thải ghép cấp tính trong cấy ghép thận đồng loại, mới ghép, ở người lớn và trẻ em 1-17 tuổi.
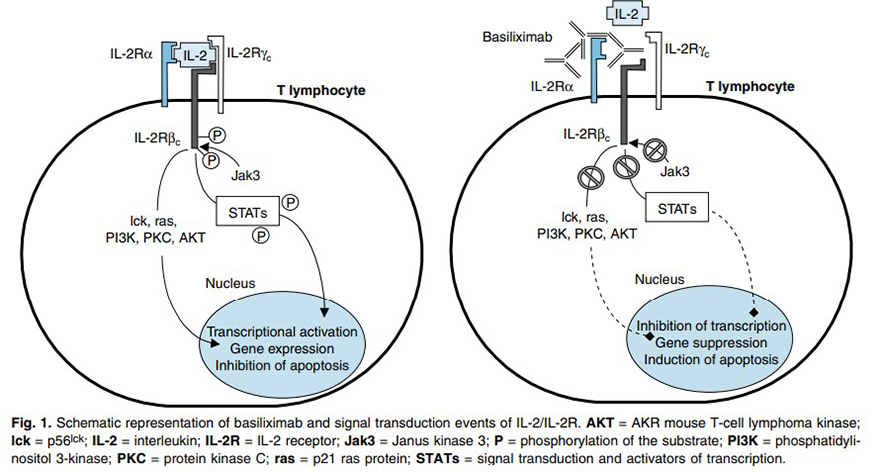
Hình 7. Cơ chế tác dụng của basiliximab 14
Emicizumab
Emicizumab là kháng thể đơn dòng được cấp phép điều trị bệnh máu khó đông bẩm sinh (Hemophialia A – HA), với cơ chế tác dụng không liên quan với tiêu diệt tế bào hay ức chế miễn dịch.
HA là rối loạn di truyền liên quan đến nhiễm sắc thể X do khiếm khuyết trong gen mã hóa yếu tố VIII (FVIII), đặc trưng bởi tình trạng thiếu hụt FVIII, làm tăng nguy cơ chảy máu vào khớp, cơ và mô mềm trong khi không có dấu hiệu chấn thương hoặc tổn thương. Yếu tố VIII hoạt động như một cofactor để yếu tố IXa (FIXa) hoạt hóa yếu tố X (FX) trong quá trình đông máu và emicizumab (ACE910) được thiết kế để mô phỏng vai trò của FVIII.
Thông qua khả năng liên kết với cả FX và FIXa, emicizumab có thể xúc tác để hoạt hóa yếu tố X tương tự như FVIII. Tuy nhiên, FVIII và emicizumab không tương tự về mặt cấu trúc và có những khác biệt quan trọng. Thứ nhất, so với FVIII có liên kết đa vị trí, emicizumab chỉ có một vị trí tương tác duy nhất, vì vậy tương tác giữa emicizumab với FIXa yếu hơn 100 lần và tương tác với FX yếu hơn 6 lần so với FVIII. Ngoài ra, do liên kết với emicizumab không yêu cầu hoạt hóa/phân giải protein như FVIII, tính đặc hiệu của emicizumab với FIXa và FX cũng kém hơn FVIII. Mặt khác, các cơ chế tự nhiên gây bất hoạt FVIII (VD: phân hủy protein do protease serine) không gây ảnh hưởng đến emicizumab. Sự khác biệt lớn nhất là emicizumab chỉ có khả năng bắc cầu để enzyme (FIXa) tương tác với chất nền (FX), trong khi FVIII còn hỗ trợ định vị FIXa và định hướng/ổn định vị trí hoạt động của yếu tố này 15.
Tài liệu tham khảo
1. Hafeez U, Gan HK, Scott AM. Monoclonal antibodies as immunomodulatory therapy against cancer and autoimmune diseases. Curr Opin Pharmacol. Aug 2018;41:114-121. doi:10.1016/j.coph.2018.05.010
2. Rosenberg A, Demeule B. Biobetters: Protein Engineering to Approach the Curative. American Association of Pharmaceutical Scientists; 2015:82-84.
3. Castelli MS, McGonigle P, Hornby PJ. The pharmacology and therapeutic applications of monoclonal antibodies. Pharmacol Res Perspect. Dec 2019;7(6):e00535. doi:10.1002/prp2.535
4. Zahavi D, Weiner L. Monoclonal Antibodies in Cancer Therapy. Antibodies (Basel). Jul 20 2020;9(3)doi:10.3390/antib9030034
5. Lee W, Lee SM, Jung ST. Unlocking the Power of Complement-Dependent Cytotoxicity: Engineering Strategies for the Development of Potent Therapeutic Antibodies for Cancer Treatments. BioDrugs. Sep 2023;37(5):637-648. doi:10.1007/s40259-023-00618-1
6. Sewnath CA, Behrens LM, van Egmond M. Targeting myeloid cells with bispecific antibodies as novel immunotherapies of cancer. Expert Opin Biol Ther. Aug 2022;22(8):983-995. doi:10.1080/14712598.2022.2098675
7. Jang DI, Lee AH, Shin HY, et al. The Role of Tumor Necrosis Factor Alpha (TNF-alpha) in Autoimmune Disease and Current TNF-alpha Inhibitors in Therapeutics. Int J Mol Sci. Mar 8 2021;22(5)doi:10.3390/ijms22052719
8. Macklis RM. Radioimmunotherapy as a therapeutic option for Non-Hodgkin’s lymphoma. Semin Radiat Oncol. Jul 2007;17(3):176-83. doi:10.1016/j.semradonc.2007.02.003
9. Bộ Y tế. Dược thư Quốc gia Việt Nam. 2022.
10. Eng GP. Optimizing biological treatment in rheumatoid arthritis with the aid of therapeutic drug monitoring. Dan Med J. Nov 2016;63(11)
11. Akiho H, Yokoyama A, Abe S, et al. Promising biological therapies for ulcerative colitis: A review of the literature. World J Gastrointest Pathophysiol. Nov 15 2015;6(4):219-27. doi:10.4291/wjgp.v6.i4.219
12. Mease PJ. Adalimumab in the treatment of arthritis. Ther Clin Risk Manag. Mar 2007;3(1):133-48. doi:10.2147/tcrm.2007.3.1.133
13. Sebba A. Tocilizumab: the first interleukin-6-receptor inhibitor. Am J Health Syst Pharm. Aug 1 2008;65(15):1413-8. doi:10.2146/ajhp070449
14. Boggi U, Danesi R, Vistoli F, et al. A benefit-risk assessment of basiliximab in renal transplantation. Drug Saf. 2004;27(2):91-106. doi:10.2165/00002018-200427020-00002
15. Lenting PJ, Denis CV, Christophe OD. Emicizumab, a bispecific antibody recognizing coagulation factors IX and X: how does it actually compare to factor VIII? Blood. Dec 7 2017;130(23):2463-2468. doi:10.1182/blood-2017-08-801662
Biên tập: DS. Lê Thị Nguyệt Minh