Cùng với sự chuyển dịch xu hướng nghiên cứu của ngành công nghệ dược phẩm thế giới, từ thuốc hóa dược sang thuốc sinh học, nhóm thuốc kháng thể đơn dòng (monoclonal antibodies – mAbs) đã ra đời và được ứng dụng thành công trên lâm sàng để điều trị ung thư, nhiễm virus, bệnh viêm tự miễn cùng nhiều chỉ định khác. Tính đặc hiệu cao với đích kháng nguyên giúp mAbs trở thành liệu pháp đột phá trong bối cảnh các tình trạng này. Tuy nhiên, việc sử dụng lặp đi lặp lại mAbs có thể gây đáp ứng sinh miễn dịch của cơ thể thông qua hình thành các kháng thể kháng thuốc (anti-drug antibodies – ADA). Sự xuất hiện của ADA làm thay đổi tính chất dược động học, dược lực học của thuốc, từ đó giảm hiệu quả điều trị. Trong một số trường hợp nghiêm trọng, ADA có thể trung hòa hoàn toàn tác dụng điều trị của thuốc hoặc gây những tác dụng không mong muốn nguy hiểm 1,2.

Hình 1. Quy trình tổng hợp kháng thể đơn dòng
1. Cơ chế và các yếu tố ảnh hưởng tới sự hình thành kháng thể kháng thuốc
ADA hình thành trong cơ thể theo con đường phụ thuộc tế bào T hoặc con đường không phụ thuộc tế bào T. Đối với con đường phụ thuộc tế bào T, mAbs đóng vai trò tương tự kháng nguyên, được xử lý bởi các tế bào trình diện kháng nguyên (APC). Các APC trình diện mAbs tới tế bào Th (T helper), tế bào này sau đó tương tác với tế bào B, dẫn tới sự biệt hóa tế bào B thành tế bào giải phóng ADA. Đối với con đường không phụ thuộc tế bào T, mAbs gắn trực tiếp lên tế bào B, dẫn tới sự biệt hóa tế bào B và hình thành ADA 1-3.
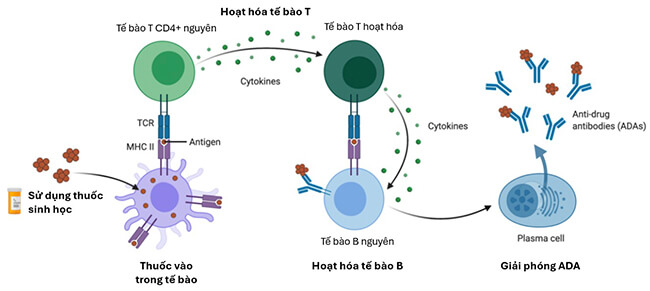
Hình 2. Cơ chế ntADA
Nghiên cứu gợi ý sự hình thành ADA phụ thuộc vào yếu tố thuốc (sản phẩm của quá trình glycosyl hóa thuốc, tạp chất, đoạn protein không có ở người), bệnh nhân (đặc điểm bệnh, đặc điểm gen, thuốc miễn dịch dùng đồng thời) và đường dùng cũng như tần suất sử dụng mAbs 4. Thực tế, việc xác định nguyên nhân và cơ chế hình thành ADA tương đối phức tạp do một số bệnh nhân xuất hiện ADA trong khi một số bệnh nhân khác có tình trạng bệnh tương tự, được điều trị bằng liệu pháp tương tự thì không. Mức độ sinh miễn dịch khác nhau giữa các bệnh nhân điều trị cùng một mAb có thể liên quan đến con đường miễn dịch trong cơ chế bệnh sinh. Các bệnh nhân mắc bệnh giai đoạn đầu thường có nồng độ ADA cao hơn các bệnh nhân giai đoạn sau 1. Sự khác biệt về di truyền cũng ảnh hưởng tới việc kích thích hoặc ức chế phản ứng sinh ADA. Một số nghiên cứu đã chỉ ra mối tương quan giữa sự hình thành ADA với kiểu hình gen HLA trong quần thể 1. Các nghiên cứu khác cũng gợi ý một số yếu tố liên quan đến thuốc ảnh hưởng đến mức độ sinh miễn dịch của mAbs, bao gồm: nguồn gốc kháng thể (từ chuột, từ người…), liều dùng, tần suất dùng, đường dùng, đích tác dụng, tạp chất…1,2
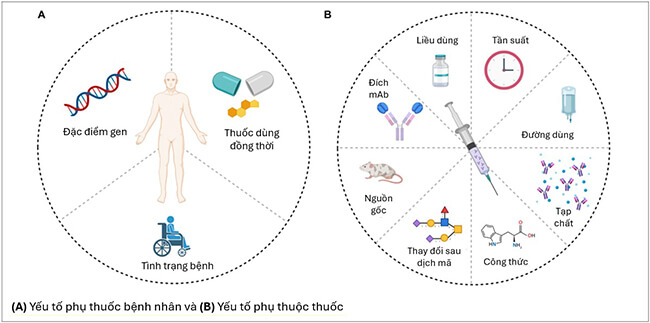
Hình 3. Các yếu tố hình thành ADA (A) phụ thuộc bệnh nhân và (B) phụ thuộc thuốc
2. Cơ chế tác dụng của các kháng thể kháng thuốc
Cơ chế của ADA có thể được phân loại thành (1) kháng thể trung hòa mAbs (ntADA) và (2) kháng thể không trung hòa mAbs (non-ntADA). Các ntADA ức chế trực tiếp hoạt động của mAbs bằng cách gắn với vị trí hoạt động hoặc gắn vào các vùng ức chế trên cấu trúc mAbs, làm mất khả năng gắn kháng nguyên của mAbs. Trong khi đó, các non-ntADA không trực tiếp làm mất khả năng gắn kháng nguyên nhưng tác động vào các epitope khác có trên mAbs và làm thay đổi đặc tính dược động học, dược lực học của thuốc 2,4.
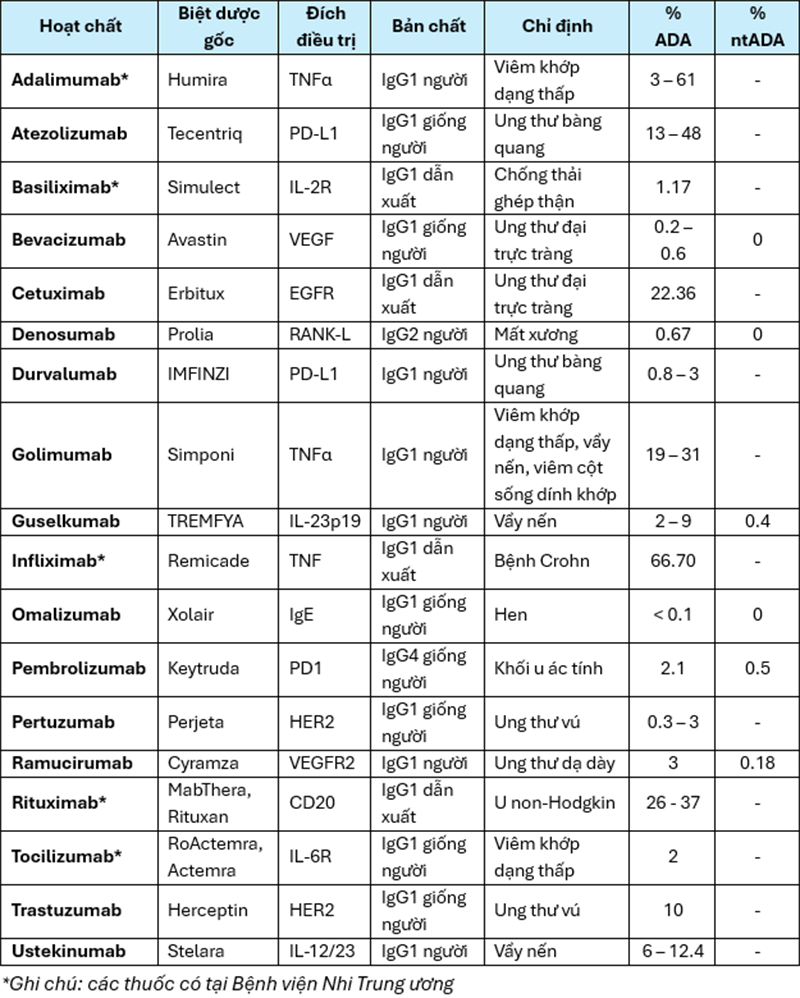
Khả năng hình thành ADA và đặc điểm của một số mAbs được cấp phép ở Việt Nam được tổng hợp trong Bảng 1 1,2,4.
Bảng 1. Khả năng hình thành ADA và đặc điểm một số mAbs
3. Ảnh hưởng trên lâm sàng của kháng thể kháng thuốc
Sự hình thành ADA dẫn tới những kết quả lâm sàng khác nhau, từ giảm hoặc mất hiệu quả điều trị tới xuất hiện độc tính nghiêm trọng. Nhìn chung, hậu quả về mặt lâm sàng của ADA thường bao gồm: (1) giảm hiệu quả điều trị, (2) can thiệp vào chức năng của protein nội sinh thông qua phản ứng chéo hoặc (3) thay đổi đặc tính miễn dịch 2,5.
Khả năng sinh miễn dịch là một trong những nguyên nhân gây lo ngại khi chuyển đổi từ thuốc sinh học gốc (biologic) sang thuốc tương tự sinh học (biosimilar), đặc biệt ở nhóm thuốc mAbs. Điều này ảnh hưởng nhiều đến việc kê đơn các thuốc tương tự sinh học của bác sĩ. Một số giả thuyết cho rằng việc chuyển đổi giữa các chế phẩm này kích thích hệ miễn dịch phát hiện ra các khác biệt nhỏ trong cấu trúc, từ đó làm tăng phản ứng miễn dịch toàn thể; hoặc làm tăng phơi nhiễm với các kháng nguyên epitope và làm nghiêm trọng hơn tình trạng sinh ADA. Tuy nhiên, bằng chứng thực tế hiện nay lại cho thấy không có dữ liệu lâm sàng ủng hộ giả thuyết về sự khác biệt trong khả năng sinh miễn dịch của thuốc sinh học và tương tự sinh học. Tổng quan 178 nghiên cứu lâm sàng so sánh việc chuyển đổi giữa thuốc tương tự sinh học và chế phẩm gốc không có bằng chứng về biến cố bất lợi liên quan đến chuyển đổi thuốc, bao gồm cả phản ứng sinh miễn dịch (trong điều kiện thuốc tương tự sinh học được nghiên cứu và cấp phép theo đúng quy trình, tiêu chuẩn áp dụng với chế phẩm gốc) 6. Ngoài ra, việc có thể sử dụng các thuốc kháng thể đơn dòng tương tự sinh học đồng nghĩa với khả năng giảm bớt gánh nặng về chi phí và mở rộng cơ hội điều trị cho bệnh nhân mắc các bệnh đặc thù như ung thư, bệnh tự miễn…
3.1. Kháng thể đơn dòng đối kháng TNFα
Các mAbs có đích yếu tố hoại tử khối u (TNFα) bao gồm infliximab và adalimumab, được sử dụng để điều trị bệnh viêm khớp dạng thấp và bệnh viêm ruột Crohn. Khả năng sinh miễn dịch của các thuốc này có thể được ức chế bởi các thuốc ức chế miễn dịch (đặc biệt là methotrexate) tới khoảng 80%. Ở các bệnh nhân điều trị viêm khớp dạng thấp với adalimumab, nhóm bệnh nhân đơn trị bằng mAbs có tỷ lệ sinh miễn dịch cao hơn so với đồng trị liệu bằng mAbs và thuốc ức chế miễn dịch sau 6 tháng 4.
Trên trẻ em, tỷ lệ hình thành ADA với infliximab cao hơn người lớn. Trong một nghiên cứu bao gồm bệnh nhi điều trị bệnh Crohn, 12% bệnh nhân nghiên cứu dương tính với kháng thể mặc dù đã được bổ sung các liệu pháp ức chế miễn dịch khác nhau. Một nghiên cứu bao gồm bệnh nhi điều trị viêm loét đại tràng bằng infliximab, tỷ lệ dương tính với kháng thể là 25%, không sử dụng liệu pháp ức chế miễn dịch 4.
3.2. Một số mAbs khác
Rituximab là dẫn xuất mAbs từ chuột và người, có khả năng ức chế CD20. Do nguồn gốc từ chuột, sự hình thành ntADA khá thường gặp trên lâm sàng. Các nghiên cứu cho thấy tỷ lệ sinh miễn dịch là 26.4% trên bệnh nhân dùng rituximab ở tuần thứ 48 và 11% trên bệnh nhân dùng đồng thời với methotrexat sau 8 – 12 tuần. Kháng thể kháng rituximab làm giảm hiệu quả của thuốc trong những nghiên cứu tương tự 4.
Tocilizumab là kháng thể IgG1 tương tự kháng thể người, hoạt động theo cơ chế ngăn chặn liên kết giữa IL-6 và IL-6R, ức chế hoạt động IL-6. Các nghiên cứu cho thấy tính sinh miễn dịch của tocilizumab tương đối thấp (<2% bệnh nhân) và sự hình thành ADA không ảnh hưởng đến dược động học hoặc tính an toàn của thuốc 4.
TÀI LIỆU THAM KHẢO
1. Vaisman-Mentesh A, Gutierrez-Gonzalez M, DeKosky BJ, Wine Y. The Molecular Mechanisms That Underlie the Immune Biology of Anti-drug Antibody Formation Following Treatment With Monoclonal Antibodies. Review. Frontiers in Immunology. 2020-August-18 2020;11doi:10.3389/fimmu.2020.01951
2. Harris CT, Cohen S. Reducing Immunogenicity by Design: Approaches to Minimize Immunogenicity of Monoclonal Antibodies. BioDrugs. 2024/03/01 2024;38(2):205-226. doi:10.1007/s40259-023-00641-2
3. Gomez-Mantilla JD, Troconiz IF, Parra-Guillen Z, Garrido MJ. Review on modeling anti-antibody responses to monoclonal antibodies. J Pharmacokinet Pharmacodyn. Oct 2014;41(5):523-36. doi:10.1007/s10928-014-9367-z
4. Mosch R, Guchelaar H-J. Immunogenicity of Monoclonal Antibodies and the Potential Use of HLA Haplotypes to Predict Vulnerable Patients. Review. Frontiers in Immunology. 2022-June-17 2022;13doi:10.3389/fimmu.2022.885672
5. Garces S, Demengeot J. The Immunogenicity of Biologic Therapies. Curr Probl Dermatol. 2018;53:37-48. doi:10.1159/000478077
6. Pekka K. No need for systematic switch studies to demonstrate interchangeability of biosimilars. Generics and Biosimilars Initiative Journal. 2022; doi: 10.5639/gabij.2022.1101.002
Biên tập: DS. Lê Thị Nguyệt Minh
Khoa Dược – Bệnh viện Nhi Trung ương